1. Экстенсивные и интенсивные свойства системы. В чем состоит различие этих свойств? 2. Напишите выражение парциальной молярной величины (свойства) для i–того компонента, если общее интегральное свойство системы L.
- Химия
Условие:
Термодинамика растворов
Расчет термодинамических функций в двухкомпонентных системах
1. Экстенсивные и интенсивные свойства системы. В чем состоит различие этих свойств?
2. Напишите выражение парциальной молярной величины (свойства) для i–того компонента, если общее интегральное свойство системы L.
3. Способы выражения состава раствора. Дайте математическое выражение молярной (Ci), моляльной (mi), массовой (процентной) концентрации (wi) и мольной доли (xi) компонента раствора.
4. Что называется молем раствора?
5. Первое уравнение Гиббса–Дюгема. Связь интегрального свойства раствора L с парциальными молярными свойствами компонентов 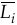 .
.
6. Приведите выражение, связывающее термодинамическую функцию смешения LM (изменение интегрального свойства DLcм) при образовании системы (раствора) из чистых компонентов с парциальными молярными функциями смешения компонентов LiM (относительными парциальными молярными энтальпиями 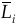 ) для двухкомпонентной системы.
) для двухкомпонентной системы.
7. Рассчитайте функции смешения GM, HM, SM, VM для системы вода – метанол (табл. 6) в предположении образования 1 моль идеального раствора указанной в задании концентрации.
Таблица 6
Система вода – метанол. Вариант №17.
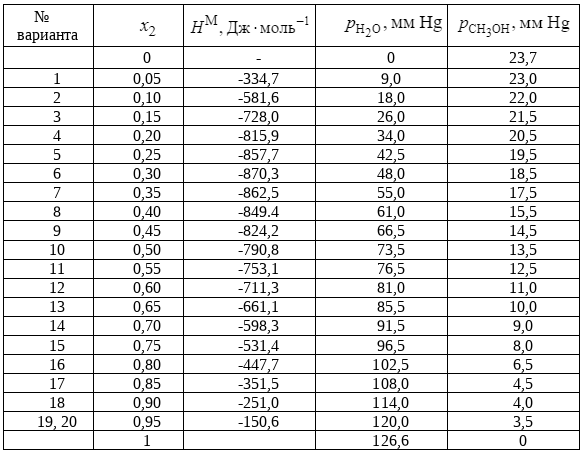
8. Постройте график НMm =f(x2), где х2 - мольная доля метанола.
9. Определите по графику парциальные молярные энтальпии смешения воды (Н1М) и метанола (Н2М) для концентрации х= 0,35.
10. Определите по графику парциальные молярные энтальпии смешения воды (Н1М) и метанола (Н2М) для концентрации, указанной в задании. х2= 0,85.
11. По данным о давлении насыщенного пара чистых веществ и парциальных давлений компонентов при Т = 298 К (система Н2О – СН3ОН, табл. 6) определите рациональные активности (ах) и коэффициенты активности (γх) обоих компонентов при указанной концентрации раствора.
12. Определите изменение химического потенциала каждого компонента Dμi и энергию Гиббса смешения GM при образовании 1 моля раствора заданной концентрации.
13. Постройте график зависимости парциального давления воды, метанола и общего давления в системе от мольной доли второго компонента. Нанесите на график аналогичные зависимости по закону Рауля. Укажите тип отклонений от закона Рауля.
Решение:
1.Экстенсивные параметры системы величины, пропорциональные массе (или количеству вещества) рассматриваемой системы, к ним относятся: объем, внутренняя энергия, энтальпия, теплоемкость и др.
Интенсивные параметры величины, не зависящие от массы рассматриваемой системы и служащие термодинамическими параметрами состояния системы: температура и давление.
2. Экстенсивные величины являются аддитивными функциями по отношению к парциальным молярным величинам:
L = (Lini)
3.Молярная концентрация (молярность) Сi - количество молей растворенного вещества в 1 литре (1 дм3) раствора:
Ci = ni/V (моль...
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
AI помощники
Выбери предмет
- Правоохранительные органы
- Пожарная безопасность
- Парикмахерское искусство
- Природообустройство и водопользование
- Почвоведение
- Приборостроение и оптотехника
- Промышленный маркетинг и менеджмент
- Производственный маркетинг и менеджмент
- Процессы и аппараты
- Программирование
- Право и юриспруденция
- Психология
- Политология
- Педагогика
- Трудовое право
- Теория государства и права (ТГП)
- Таможенное право
- Теория игр
- Теория вероятностей
- Теоретическая механика
- Теория управления
- Технология продовольственных продуктов и товаров
- Технологические машины и оборудование
- Теплоэнергетика и теплотехника
- Туризм
- Товароведение
- Таможенное дело
- Торговое дело
- Теория машин и механизмов
- Транспортные средства