аш2с(г) плюс цл2(г) равно 2аш цл(г) плюс с(к) . Рассчитайте энтальпию H0298 и энтропию rS0298 заданной химической реакции
- Химия
Условие:
1. Для химической реакции вашего варианта выпишите из справочника необходимую для расчетов информацию: 
2. Рассчитайте энтальпию  и энтропию
и энтропию  заданной химической реакции.
заданной химической реакции.
3. Определите, какой из факторов, энтальпийный или энтропийный, способствует самопроизвольному протеканию реакции.
4. Рассчитайте стандартную энергию Гиббса реакции  при Т=298 К двумя способами.На основании полученного значения
при Т=298 К двумя способами.На основании полученного значения  сделайте вывод о возможности самопроизвольного протекания процесса в прямом направлении при стандартных состояниях всех веществ, участвующих в реакции, и температуре 298 К.
сделайте вывод о возможности самопроизвольного протекания процесса в прямом направлении при стандартных состояниях всех веществ, участвующих в реакции, и температуре 298 К.
5. Считая, что стандартные энтальпия и энтропия реакции не зависят от температуры (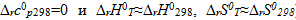 ), рассчитайте температуру, при которой равновероятны оба направления реакции и определите область температур, в которой возможно самопроизвольное протекание процесса.
), рассчитайте температуру, при которой равновероятны оба направления реакции и определите область температур, в которой возможно самопроизвольное протекание процесса.
6. Определите, может ли самопроизвольно протекать данная реакция при 500К и начальных относительных парциальных давлениях газообразных компонентов:
 − для исходных веществ и
− для исходных веществ и  − для продуктов. Изменится ли направление протекания процесса, если приТ=500 К все вещества будут находиться в стандартных состояниях?
− для продуктов. Изменится ли направление протекания процесса, если приТ=500 К все вещества будут находиться в стандартных состояниях?
H2S(г) + Cl2(г) = 2HCl(г) + S(к)
Решение:
H2S (г) + Cl2 (г) = 2HCl (г) + S (к)
1. ∆Н(HCl) = 92,3кДж/моль; ∆Н(S) = 0 кДж/моль; ∆Н(H2S) = 21 кДж/моль; ∆Н(Cl2) = 0 кДж/моль
S(HCl) = 186,8 Дж/моль∙K; S(S) = 31,9 Дж/моль∙K; S(H2S) = 205,7 Дж/моль∙K; S(Cl2) = 222,9 Дж/моль∙K
∆G(HCl) = -95,2 кДж/моль; ∆G(S) = 0 кДж/моль; ∆G(H2S) = -33,8 кДж/моль; ∆G(Cl2) = 0 кДж/моль
2. Изменение энтальпии реакции рассчитывается как:
∆H реакции = ∆Hпродуктов - ∆Hисходных веществ
∆H реакции = (2∙∆Н(HCl) + ∆Н(S)) - (∆Н(H2S) + ∆Н(Cl2))
∆H реакции = (2∙(92,3 + 0) (21 + 0) = -163,6 кДж реакция экзотермическ...
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
AI помощники
Выбери предмет
- Правоохранительные органы
- Пожарная безопасность
- Парикмахерское искусство
- Природообустройство и водопользование
- Почвоведение
- Приборостроение и оптотехника
- Промышленный маркетинг и менеджмент
- Производственный маркетинг и менеджмент
- Процессы и аппараты
- Программирование
- Право и юриспруденция
- Психология
- Политология
- Педагогика
- Трудовое право
- Теория государства и права (ТГП)
- Таможенное право
- Теория игр
- Теория вероятностей
- Теоретическая механика
- Теория управления
- Технология продовольственных продуктов и товаров
- Технологические машины и оборудование
- Теплоэнергетика и теплотехника
- Туризм
- Товароведение
- Таможенное дело
- Торговое дело
- Теория машин и механизмов
- Транспортные средства