Коллоидный раствор (золь) АД получен при смешивании V1 мл водного раствора АС с молярной концентрацией С1 и V2 мл водного раствора ВД с молярной концентрацией С2. 1. Напишите уравнение реакции и определите, какой из продуктов реакции образует золь
- Химия
Условие:
Коллоидный раствор (золь) АД получен при смешивании V1 мл водного раствора АС с молярной концентрацией С1 и V2 мл водного раствора ВД с молярной концентрацией С2.
1. Напишите уравнение реакции и определите, какой из продуктов реакции образует золь (данные в табл.).
2. Рассчитайте, какое из исходных веществ – АС или ВД – взято в избытке.
3. Напишите формулу мицеллы образовавшегося золя АД и укажите заряд коллоидной частицы (гранулы).
4. Предложите методы определения заряда коллоидной частицы (гранулы).
5. Для данных электролитов: K2SO4, NaNO3, Na3PO4, MgCl2, CdSO4, Al2(SO4)3.
5.1. Определите, какой из ионов электролита будет вызывать коагуляцию, и расположите ионы в ряд в порядке уменьшения порога коагуляции.
5.2. Рассчитайте пороги коагуляции Ск в золе АД для каждого из предложенных электролитов, используя правило Шульца-Гарди или закономерность Дерягина-Ландау, если порог коагуляции гидрозоля АД под действием электролита KNO3 равен Ск (данные в табл.).
5.3. Выберите наиболее экономичный электролит–коагулятор и рассчитайте расход данного электролита (массу в кг) на очистку 1000 м3 сточных вод от золя АД.
5.4. Предложите другие методы очистки сточных вод от коллоидных примесей вещества АД.
5.5. Выберите показатели качества воды (физические: запах, вкус, цветность, прозрачность, мутность, плотность; химические: электрическая проводимость, солесодержание, рН, окисляемость, жесткость и др.), которые можно использовать для контроля эффективности очистки воды от коллоидных примесей вещества АД методом коагулирования.
Таблица
Дано:
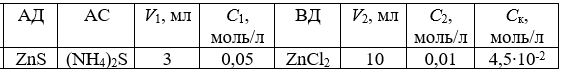
Решение:
1. (NH4)2S + ZnCl2 = ZnS(золь) + 2NH4Cl
Золь образует ZnS, так как он плохо растворим в воде.
2. Вычислим число молей эквивалентов веществ (NH4)2S и ВД:
п(1/2 (NH4)2S) = С1,экв∙V1∙10-3,
где С1,экв молярная концентрация эквивалента (NH4)2S, равна молярной концентрации этого раствора, умноженной на 2 (так как в состав молекулы входят два однозарядных иона NH4+); равна 2∙0,05 = 0,10 моль/л;
V1 объём раствора (NH4)2S, равен 3 мл;
10-3 коэффициент перевода мл в л.
п(1/2 (NH4)2S) = 0,10∙3∙10-3 = 0,3∙10-3 (моль экв).
п(1/2 ZnCl2) = С2,экв∙V2∙10-3,
где С2,экв молярна...
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
AI помощники
Выбери предмет
- Правоохранительные органы
- Пожарная безопасность
- Парикмахерское искусство
- Природообустройство и водопользование
- Почвоведение
- Приборостроение и оптотехника
- Промышленный маркетинг и менеджмент
- Производственный маркетинг и менеджмент
- Процессы и аппараты
- Программирование
- Право и юриспруденция
- Психология
- Политология
- Педагогика
- Трудовое право
- Теория государства и права (ТГП)
- Таможенное право
- Теория игр
- Теория вероятностей
- Теоретическая механика
- Теория управления
- Технология продовольственных продуктов и товаров
- Технологические машины и оборудование
- Теплоэнергетика и теплотехника
- Туризм
- Товароведение
- Таможенное дело
- Торговое дело
- Теория машин и механизмов
- Транспортные средства