Определение возможности протекания химической реакции в стандартных и нестандартных условиях. Выполните следующие задания для заданной реакции: 1.По значениям стандартных энтальпий образования участвующих в реакции веществ ∆Нf,298 вычислите тепловой
- Химия
Условие:
Определение возможности протекания химической реакции в стандартных и нестандартных условиях.
Выполните следующие задания для заданной реакции:
1.По значениям стандартных энтальпий образования участвующих в реакции веществ ∆Нf,298 вычислите тепловой эффект реакции при стандартных условиях ∆Н298. Выделяется или поглощается тепло при протекании реакции? Эндо- или экзотермической является данная реакция?
2. Для исходных веществ и продуктов реакции определите величины средних теплоемкостей 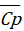 в диапазоне температур 298-Т и изменение теплоемкости
в диапазоне температур 298-Т и изменение теплоемкости  в ходе реакции. Пользуясь законом Кирхгофа, вычислите тепловой эффект реакции ∆НТ при температуре Т и стандартном давлении с учетом величины
в ходе реакции. Пользуясь законом Кирхгофа, вычислите тепловой эффект реакции ∆НТ при температуре Т и стандартном давлении с учетом величины 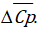
3.Выведите для реакции функциональную зависимость изменения молярной изобарной теплоемкости от температуры: 
4.Вычислите величину ∆Н0Т, пользуясь законом Кирхгофа и установленной функциональной зависимостью  Как влияет увеличение температуры на величину теплового эффекта реакции?
Как влияет увеличение температуры на величину теплового эффекта реакции?
5.Качественно оцените знак изменения энтропии ∆S при протекании реакции. Объясните полученный результат. По значениям стандартных энтальпий участвующих в реакции веществ S0298 вычислите изменение энтропии реакции при стандартных условиях ∆S0298.
6.Используя функциональную зависимость  вычислите изменение энтропии реакции ∆S0Т при температуре Т и стандартном давлении. Как повлияет повышение температуры на величину ∆S0Т?
вычислите изменение энтропии реакции ∆S0Т при температуре Т и стандартном давлении. Как повлияет повышение температуры на величину ∆S0Т?
7. Качественно оцените вероятность самопроизвольного протекания реакции при высоких и низких температурах. Вычислите изменение энергии Гиббса ∆G0298 реакции, протекающей при стандартных условиях. Возможно ли самопроизвольное протекание процесса при стандартных условиях? Определите температуру Т0, при которой реакция меняет свое направление.
8. Вычислите изменение энергии Гиббса ∆G0Т реакции, протекающей при стандартном давлении и температуре Т, считая, что ∆H0Т и ∆S0Т не зависят от температуры (метод Улиха). Постройте график зависимости ∆G0Т от температуры. Сделайте вывод о влиянии температуры на вероятность самопроизвольного протекания процесса в прямом направлении.
9. Вычислите изменение энергии Гиббса ∆G0Т реакции, протекающей при стандартном давлении и температуре Т, учитывая зависимость ∆H0Т и ∆S0Т от температуры. Сравните полученные значения ∆G0Т с величиной изменения энергии Гиббса, рассчитанной по методу Улиха, и оцените их расхождение.
Исходные данные:
Mg(OH)2 (т) = MgO(т) + H2O(г)
Т = 500 К.
Решение:
1. Выпишем из справочника необходимые данные:


Рассчитаем тепловой эффект реакции при стандартных условиях согласно следствию из закона Гесса:
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
AI помощники
Выбери предмет
- Правоохранительные органы
- Пожарная безопасность
- Парикмахерское искусство
- Природообустройство и водопользование
- Почвоведение
- Приборостроение и оптотехника
- Промышленный маркетинг и менеджмент
- Производственный маркетинг и менеджмент
- Процессы и аппараты
- Программирование
- Право и юриспруденция
- Психология
- Политология
- Педагогика
- Трудовое право
- Теория государства и права (ТГП)
- Таможенное право
- Теория игр
- Теория вероятностей
- Теоретическая механика
- Теория управления
- Технология продовольственных продуктов и товаров
- Технологические машины и оборудование
- Теплоэнергетика и теплотехника
- Туризм
- Товароведение
- Таможенное дело
- Торговое дело
- Теория машин и механизмов
- Транспортные средства