В уравнениях окислительно-восстановительных реакций расставьте коэффициенты. Для реакции а) используйте метод электронного баланса, а для реакции б) – ионно-электронный метод.
- Химия
Условие:
В уравнениях окислительно-восстановительных реакций расставьте коэффициенты. Для реакции а) используйте метод электронного баланса, а для реакции б) – ионно-электронный метод. В каждой реакции определите окислитель и восстановитель. Вычислите ЭДС и константу равновесия реакции б). Определите направление и полноту протекания реакции в стандартных условиях. Значения стандартных электродных окислительно-восстановительных потенциалов приведены в прил., табл. П.5.
а) FeS2 + O2 → Fe2O3 + SO2
б) K2Cr2О7 + Н2S + Н2SО4 → S + Сr2(SO4)3 + K2SO4 +H2O
Таблица П.5
Стандартные электродные окислительно-восстановительные потенциалы φ0 в водных растворах при 25 °С
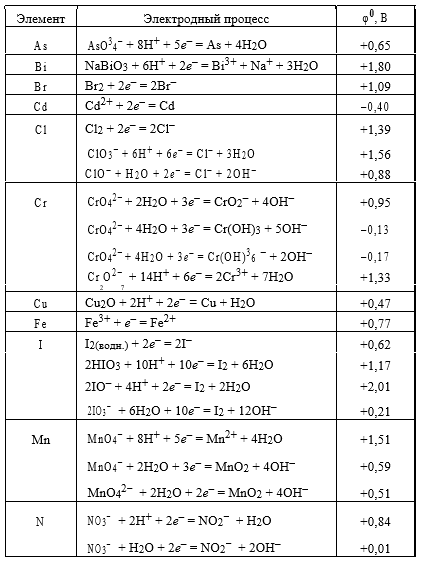
Решение:
а) 4FeS2+11O2=2Fe2O3+8SO2
2Fe+2 -2e=2Fe+3 x2 восстановитель; окисление
O20 +4e=2O-2 x1 окислитель; восстановление
FeS2 восстановитель; O2 окислитель.
б) K2Cr2О7 + Н2S + Н2SО4 S + Сr2(SO4)3 + K2SO4 +H2O
Cr2O72-+14H+ +6e=2Cr3++7H2O x1 окислитель; восстановление
H2S -2e =S+2H+...
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
AI помощники
Выбери предмет
- Правоохранительные органы
- Пожарная безопасность
- Парикмахерское искусство
- Природообустройство и водопользование
- Почвоведение
- Приборостроение и оптотехника
- Промышленный маркетинг и менеджмент
- Производственный маркетинг и менеджмент
- Процессы и аппараты
- Программирование
- Право и юриспруденция
- Психология
- Политология
- Педагогика
- Трудовое право
- Теория государства и права (ТГП)
- Таможенное право
- Теория игр
- Теория вероятностей
- Теоретическая механика
- Теория управления
- Технология продовольственных продуктов и товаров
- Технологические машины и оборудование
- Теплоэнергетика и теплотехника
- Туризм
- Товароведение
- Таможенное дело
- Торговое дело
- Теория машин и механизмов
- Транспортные средства