Вы работаете в должности лаборанта в аналитической химической лаборатории. Для проведения анализа Вам необходимо приготовить раствор соли Мора 100 мл с концентрацией раствора 0,02н
- Химия
Условие:
Вы работаете в должности лаборанта в аналитической химической лаборатории. Для проведения анализа Вам необходимо приготовить раствор соли Мора 100 мл с концентрацией раствора 0,02н и определить его точную концентрацию, используя метод титрования с перманганатом калия (0,05 н).
Опишите порядок своих действий при титровании и приведите необходимые расчеты при установлении точной концентрации раствора соли Мора.
Условия выполнения задания
1. Место (время) выполнения задания – модель заводской химической лаборатории.
2. Максимальное время выполнения задания: 45 мин.
3. Вы можете воспользоваться: бюретка вместимостью на 25 мл, пипетки Мора на 10 мл, мерные колбы на 100 мл, конические колбы на 250 мл, аналитические весы, дистиллированная вода и реактивы (соль Мора FeSO4·(NH4)2SO4·6H2O, КMnO4, раствор 2н Н2SO4).
Методические рекомендации
1. Подготовить бюретку к работе.
Бюретку промывают дистиллированной водой, а затем ополаскивают 2 раза небольшим количеством стандартного раствора KMnO4. Наполняют бюретку раствором KMnO4, удаляют пузырьки воздуха и устанавливают уровень жидкости на нуле по верхнему краю мениска.
2. Приготовить контрольный раствор.
Точную навеску 0,7843 г соли Мора растворяют в небольшом количестве воды и количественно переносят в коническую колбу на 100 мл. Доводят объем контрольного раствора в мерной колбе на 100,0 мл дистиллированной водой до метки. В чистую коническую колбу переносят пипеткой 10,0 мл соли Мора, предварительно ополоснув пипетку этим же раствором.
3. Титрование контрольного раствора соли аммония.
В коническую колбу с разбавленным раствором соли Мора добавляют мерным цилиндром 10 мл 2 н H2SO4. После чего титруют ее стандартизованным раствором KMnO4 до появления устойчивой в течение 30 с бледно-розовой окраски от одной лишней капли перманганата.
4. Титрование повторяют до получения 3-х сходимых результатов.
5. Рассчитывают средний объем раствора KMnO4, пошедший на титрование (V, мл), и точную концентрацию раствора соли Мора по формуле:
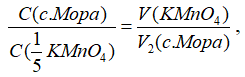
где С(с.Мора) – нормальная концентрация раствора соли Мора, н; С(1/5 KMnO4) – нормальная концентрация раствора KMnO4, н; V (KMnO4) – объем раствора KMnO4, пошедший на титрование аликвоты соли Мора, мл; V2(c.Мора) – объем аликвоты раствора соли Мора для титрования, мл.
Кроме этого, необходимо указать:
- какой метод титриметрического анализа применили;
- какой прием и способ выполнения титрования использовали;
- в какой среде проводили титрование и почему;
- как определяли конечную точку титрования и почему.
Решение:
Трудовая функция: Титрование растворов для определения и проверки несложных титров с записью показаний.
Трудовое действие: Готовить растворы заданной концентрации.
Типовое задание: приготовить раствор соли Мора 100 мл с концентрацией раствора 0,02н и определить его точную концентрацию, используя метод титрования с перманганатом калия (0,05 н).
Порядок действий:
Посуда: бюретка вместимостью на 25 мл, пипетки Мора на 10 мл, мерные колбы на 100 мл, конические колбы на 250 мл, аналитические весы.
Реактивы: дистиллированная вода,...
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
AI помощники
Выбери предмет
- Правоохранительные органы
- Пожарная безопасность
- Парикмахерское искусство
- Природообустройство и водопользование
- Почвоведение
- Приборостроение и оптотехника
- Промышленный маркетинг и менеджмент
- Производственный маркетинг и менеджмент
- Процессы и аппараты
- Программирование
- Право и юриспруденция
- Психология
- Политология
- Педагогика
- Трудовое право
- Теория государства и права (ТГП)
- Таможенное право
- Теория игр
- Теория вероятностей
- Теоретическая механика
- Теория управления
- Технология продовольственных продуктов и товаров
- Технологические машины и оборудование
- Теплоэнергетика и теплотехника
- Туризм
- Товароведение
- Таможенное дело
- Торговое дело
- Теория машин и механизмов
- Транспортные средства