Для концентрационного элемента составленного из металла А в растворе электролита В с концентрацией m1 и m2 моль/одна тысяча грамм г рассчитайте ЭДС при двести девяноста восьми К. Активность вычислите по среднему коэффициенту активности
- Химия
Условие:
Для концентрационного элемента составленного из металла А в растворе электролита В с концентрацией m1 и m2 моль/1000 г рассчитайте ЭДС при 298 К. Активность вычислите по среднему коэффициенту активности, взятому из справочника или по ионной силе. Для элемента, составленного из водородного электрода в растворе электролита С с концентрацией m3 моль/1000 г и каломельного полуэлемента с концентрацией КСl m4 моль/1000 г вычислите ЭДС и рН раствора, содержащего электролит С. Диффузионную ЭДС не учитывайте. При 298 К стандартный потенциал каломельного электрода (а(Cl–) = 1) равен 0,2812 В, а ионное произведение воды 1,008∙10-14.
А– Cu; B – CuCl2, m1 = 0,02, m2 = 0,6; C – NaOH; m3 = 8; m4 = 1,5; p(H2) = 2 атм.
Решение:
ЭДС концентрационного элемента рассчитываем по формуле:
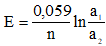
По средним коэффициентам активности, взятым из справочника вычисляем активности:
для концентрации CuCl2 0,02 моль/1000 г:
= 0,659
а1 =0,020,659 = 0,013 моль/1000 г;
для концентрации CuCl2 0,6 моль/1000 г:
= 0,416
а...
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
Выбери предмет
- Правоохранительные органы
- Пожарная безопасность
- Парикмахерское искусство
- Природообустройство и водопользование
- Почвоведение
- Приборостроение и оптотехника
- Промышленный маркетинг и менеджмент
- Производственный маркетинг и менеджмент
- Процессы и аппараты
- Программирование
- Право и юриспруденция
- Психология
- Политология
- Педагогика
- Трудовое право
- Теория государства и права (ТГП)
- Таможенное право
- Теория игр
- Текстильная промышленность
- Теория вероятностей
- Теоретическая механика
- Теория управления
- Технология продовольственных продуктов и товаров
- Технологические машины и оборудование
- Теплоэнергетика и теплотехника
- Туризм
- Товароведение
- Таможенное дело
- Торговое дело
- Теория машин и механизмов
- Транспортные средства