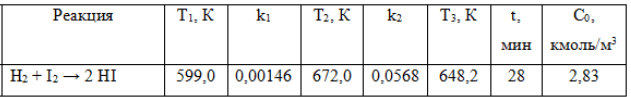
Условие:
Используя значения констант скорости k1 и k2 реакции при двух различных температурах Т1 и Т, вычислите:
1) энергию активации реакции;
2) константу скорости при температуре Т3;
3) степень превращения исходного вещества к моменту времени t (с0 – начальная концентрация);
4) температурный коэффициент скорости реакции; проверьте применимость правила Вант-Гоффа.
Порядок реакции считайте равным молекулярности. Константы скорости для реакций первого, второго и третьего порядков соответственно имеют следующие размерности: мин-1; мин-1/(кмоль/м3); мин-1/(кмоль/м3)2.
Решение:
1) Так как порядок принимаем равным молекулярности, то n = 2 (в реакции на лимитирующей стадии взаимодействуют две частицы).
2) Энергию активации рассчитаем, исходя из уравнения Аррениуса:
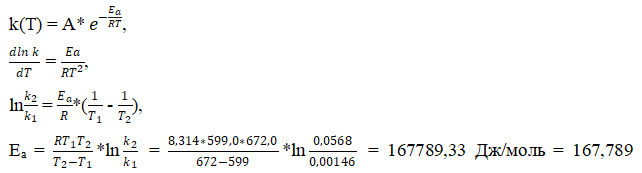
3) Определим константу k3:
