Определение скорости химических процессов. В качестве изучаемой реакции выбрана реакция взаимодействия тиосульфата натрия (Na2S2O3) с серной кислотой (H2SO4). Уравнение реакции имеет следующий вид:
- Химия
Условие:
Выполнить лабораторную работу по теме:
Определение скорости химических процессов.
Реактивы и оборудование:
- Растворы тиосульфата натрия (Na2S2O3) различной концентрации – 0,2 М; 0,3 М; 0,5 М; 1,0 М (М – означает молярность или молярная концентрация раствора);
- Раствор серной кислоты (H2SO4) с массовым соотношением 1:200;
- Химическая посуда;
- Секундомер;
- Черный экран.
В качестве изучаемой реакции выбрана реакция взаимодействия тиосульфата натрия (Na2S2O3) с серной кислотой (H2SO4). Уравнение реакции имеет следующий вид:
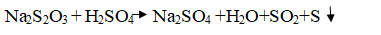
1) Внести полученные данные в таблицу 1.
Таблица 1. Время протекание и скорость химической реакции.

2) По полученным экспериментальным результатам постройте график зависимости времени реакции от концентрации раствора тиосульфата натрия.
3) Расчет значения мгновенной скорости реакции.
4) Выражение закона действующих масс для изучаемой реакции.
Решение:
1) Таблица 1. Время протекание и скорость химической реакции.

2) График зависимости времени реакции от концентрации раствора, на котором представлена касательная, угол наклона, точки пересечения с осями координат.
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
Выбери предмет
- Правоохранительные органы
- Пожарная безопасность
- Парикмахерское искусство
- Природообустройство и водопользование
- Почвоведение
- Приборостроение и оптотехника
- Промышленный маркетинг и менеджмент
- Производственный маркетинг и менеджмент
- Процессы и аппараты
- Программирование
- Право и юриспруденция
- Психология
- Политология
- Педагогика
- Трудовое право
- Теория государства и права (ТГП)
- Таможенное право
- Теория игр
- Текстильная промышленность
- Теория вероятностей
- Теоретическая механика
- Теория управления
- Технология продовольственных продуктов и товаров
- Технологические машины и оборудование
- Теплоэнергетика и теплотехника
- Туризм
- Товароведение
- Таможенное дело
- Торговое дело
- Теория машин и механизмов
- Транспортные средства