Решение задачи
Определите направление, в котором реакция может протекать самопроизвольно, используя окислительно-восстановительные потенциалы отдельных полуреакций, вычислите стандартную энергию Гиббса и константу равновесия реакций.
- Химия
Условие:
Определите направление, в котором реакция может протекать самопроизвольно, используя окислительно-восстановительные потенциалы отдельных полуреакций, вычислите стандартную энергию Гиббса 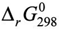 и константу равновесия реакций.
и константу равновесия реакций.
Решение:
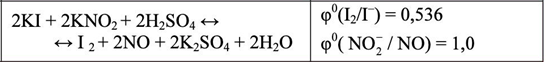
KI+ KNO2 + H2SO4 I2 + NO + K2SO4 +H2O
K+ + I- + K+ + NO2- + 2H+ + SO42- I2 + NO + 2K+ + SO42- +H2O
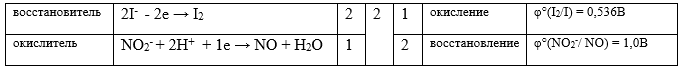
2I- + 2NO2- + 4H+ I2 + 2NO + 2H2O
2KI+ 2KNO2 + 2H2SO4 I2 + 2NO + 2K2SO4 +2H2O
Окислительно-восстановительная реакция в...
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
Выбери предмет
S
А
Б
В
Г
И
К
М
П
- Правоохранительные органы
- Пожарная безопасность
- Парикмахерское искусство
- Природообустройство и водопользование
- Почвоведение
- Приборостроение и оптотехника
- Промышленный маркетинг и менеджмент
- Производственный маркетинг и менеджмент
- Процессы и аппараты
- Программирование
- Право и юриспруденция
- Психология
- Политология
- Педагогика
Р
С
Т
- Трудовое право
- Теория государства и права (ТГП)
- Таможенное право
- Теория игр
- Текстильная промышленность
- Теория вероятностей
- Теоретическая механика
- Теория управления
- Технология продовольственных продуктов и товаров
- Технологические машины и оборудование
- Теплоэнергетика и теплотехника
- Туризм
- Товароведение
- Таможенное дело
- Торговое дело
- Теория машин и механизмов
- Транспортные средства
Ф
Э