С помощью нитрат-селективного электрода определяли содержание NО3--иона в растворе. Стандартный раствор KNO3 приготовили растворением точной навески его массой 0,4964 г в 100 мл воды.
- Химия
Условие:
С помощью нитрат-селективного электрода определяли содержание NО3--иона в растворе. Стандартный раствор KNO3 приготовили растворением точной навески его массой 0,4964 г в 100 мл воды. Из этого раствора приготовили серию более разбавленных растворов с концентрацией С(KNO3) моль/л, для чего каждый предыдущий раствор разбавляли в 10 раз водой в мерной колбе. При измерении электродных потенциалов стандартных растворов получили следующие данные (табл. 3).
Таблица 3 – Результаты измерения потенциалов стандартных растворов
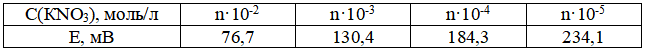
Исследуемый раствор с концентрацией Сх довели до метки водой в мерной колбе вместимостью 100 мл и измерили Ех =166,8 мВ. Рассчитать точную концентрацию стандартных растворов KNO3, построить градуировочный график и определить массу нитрат-иона в исследуемом растворе, г.
Решение:
Молярная концентрация исходного стандартного раствора равна
![]()
где т(KNO3) масса навески KNO3, равна 0,4964 г;
М(KNO3) -молярная масса KNO3, равна 39 + 14 + 16∙3 = 101 (г/моль);
V объём исходного стандартного раствора, равен 100 мл = 0,100 л.
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
Выбери предмет
- Правоохранительные органы
- Пожарная безопасность
- Парикмахерское искусство
- Природообустройство и водопользование
- Почвоведение
- Приборостроение и оптотехника
- Промышленный маркетинг и менеджмент
- Производственный маркетинг и менеджмент
- Процессы и аппараты
- Программирование
- Право и юриспруденция
- Психология
- Политология
- Педагогика
- Трудовое право
- Теория государства и права (ТГП)
- Таможенное право
- Теория игр
- Текстильная промышленность
- Теория вероятностей
- Теоретическая механика
- Теория управления
- Технология продовольственных продуктов и товаров
- Технологические машины и оборудование
- Теплоэнергетика и теплотехника
- Туризм
- Товароведение
- Таможенное дело
- Торговое дело
- Теория машин и механизмов
- Транспортные средства