Составьте схему электролиза раствора соли. Напишите электродные уравнения процессов, протекающих на электродах. Катодный процесс подтвердите расчетами.
- Химия
Условие:
1. Составьте схему электролиза раствора соли. Напишите электродные уравнения процессов, протекающих на электродах. Катодный процесс подтвердите расчетами.
2. Рассчитайте массу или (и) объем (при нормальных условиях для газов) продуктов, выделяющихся на электродах при пропускании через раствор тока силой I (А), в течение времени (t).
Раствор Sn(NO3)2
pH = 8
Анод — платина
Катод — никель
C(Sn2+) = 0,1 моль/л
η(H2) = 0,62
I = 5 A
t = 1 ч
Решение:
0(Sn2+/Sn) = 0,14 В.
Вычислим равновесный потенциал металла.
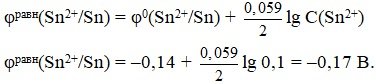
Реальный потенциал металла:
i(Sn2+/Sn) равн(Sn2+/Sn) = 0,17 В.
Вычисляем равновесный потенциал восстановления водорода.
равн(2H+/H2) = 0,059 рН = 0,059 8 = 0,472 В.
Реальный потенциал разряда водорода на катоде:
i(2H+/H2) = равн(2H+/H2) (H2/кат) = 0,472 0,62 = 1,092 В.
i(2H+/H2) i(Sn2+/Sn), поэтому на катоде идет п...
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
AI помощники
Выбери предмет
- Правоохранительные органы
- Пожарная безопасность
- Парикмахерское искусство
- Природообустройство и водопользование
- Почвоведение
- Приборостроение и оптотехника
- Промышленный маркетинг и менеджмент
- Производственный маркетинг и менеджмент
- Процессы и аппараты
- Программирование
- Право и юриспруденция
- Психология
- Политология
- Педагогика
- Трудовое право
- Теория государства и права (ТГП)
- Таможенное право
- Теория игр
- Текстильная промышленность
- Теория вероятностей
- Теоретическая механика
- Теория управления
- Технология продовольственных продуктов и товаров
- Технологические машины и оборудование
- Теплоэнергетика и теплотехника
- Туризм
- Товароведение
- Таможенное дело
- Торговое дело
- Теория машин и механизмов
- Транспортные средства