Решение задачи
Вычислить растворимость в (моль/л) Ag2CO3 в воде; в 0.01М растворе HNO3; в 0.1М растворе H2CO3. (ПР(Ag2CO3) = 8.2×10-12).
- Химия
Условие:
Вычислить растворимость в (моль/л) Ag2CO3 в воде;
в 0.01М растворе HNO3;
в 0.1М растворе H2CO3.
(ПР(Ag2CO3) = 8.2×10-12).
Решение:
В воде:
Ag2CO3 ⇄ 2Ag+ + CO32-
ПР = [Ag+]2[CO32-]
Если растворимость Ag2CO3 s моль/л, то
ПР = (2s)2 ∙ s = 4s3
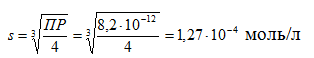
В 0.01М растворе HNO3 необходимо учитывать ионную силу раствора:
HNO3 H+ + NO3-
ПР = a2(Ag+) ∙ a(CO32-)
Так как концентрация ионов карбоната серебра намного меньше, чем концентрация ионов азотной кислоты, считаем, что только они влияют на ионную силу:
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
Выбери предмет
S
А
Б
В
Г
И
К
М
П
- Правоохранительные органы
- Пожарная безопасность
- Парикмахерское искусство
- Природообустройство и водопользование
- Почвоведение
- Приборостроение и оптотехника
- Промышленный маркетинг и менеджмент
- Производственный маркетинг и менеджмент
- Процессы и аппараты
- Программирование
- Право и юриспруденция
- Психология
- Политология
- Педагогика
Р
С
Т
- Трудовое право
- Теория государства и права (ТГП)
- Таможенное право
- Теория игр
- Текстильная промышленность
- Теория вероятностей
- Теоретическая механика
- Теория управления
- Технология продовольственных продуктов и товаров
- Технологические машины и оборудование
- Теплоэнергетика и теплотехника
- Туризм
- Товароведение
- Таможенное дело
- Торговое дело
- Теория машин и механизмов
- Транспортные средства
Ф
Э