Составьте схему гальванического элемента из цинка и железа, опущенного в растворы их солей с концентрацией ионов [Zn2+] =0,5моль/л [ Fe2+]= 1 моль/л. Рассчитайте ЭДС гальванического элемента, напишите уравнения катодного и анодного процессов
- Химия
Условие:
1. Составьте схему гальванического элемента из цинка и железа, опущенного в растворы их солей с концентрацией ионов [Zn2+] =0,5моль/л
[ Fe2+]= 1 моль/л. Рассчитайте ЭДС гальванического элемента, напишите уравнения катодного и анодного процессов
2. Найдите объем водорода, который выделится при пропускании тока силой в 3А в течение 1ч через водный раствор серной кислоты.
3. Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза водного раствора и расплава К2СО3 с инертным анодом
Решение:
Значение электродных потенциалов находим по уравнению Нернста
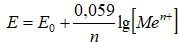 .
.
Е0( Zn2+/ Zn) = -0,76B Е( Zn2+/ Zn) = -0,76 + 0,059/2*lg[0,5] =- 0,769 B
Е0( Fe2+/ Fe) = -0,44B
Е0( Zn2+/ Zn) Е0( Fe2+/ Fe) Zn A Fe - K
A (-) Zn0 -2e =Zn2+
K (+ ) Fe2+ +2e = Fe0
Zn + Fe2+ = Zn2+ + Fe0
ЭДС = ЕК ЕА = -0,44 ( -0,769) = 0,329В
2. H2SO4 = 2H+ + SO42-
K ( - ) 2H+ +2e = H2
A ( + ) 2H2O -4e = O...
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
Выбери предмет
- Правоохранительные органы
- Пожарная безопасность
- Парикмахерское искусство
- Природообустройство и водопользование
- Почвоведение
- Приборостроение и оптотехника
- Промышленный маркетинг и менеджмент
- Производственный маркетинг и менеджмент
- Процессы и аппараты
- Программирование
- Право и юриспруденция
- Психология
- Политология
- Педагогика
- Трудовое право
- Теория государства и права (ТГП)
- Таможенное право
- Теория игр
- Текстильная промышленность
- Теория вероятностей
- Теоретическая механика
- Теория управления
- Технология продовольственных продуктов и товаров
- Технологические машины и оборудование
- Теплоэнергетика и теплотехника
- Туризм
- Товароведение
- Таможенное дело
- Торговое дело
- Теория машин и механизмов
- Транспортные средства